GLP-1靶向减重药物以其出色的临床表现已然斩获海量市场份额,围绕其展开市场格局之争也已拉开帷幕。
6月30日,歌礼制药发布公告(以下简称“公告”)披露石药集团附属公司康久普乐生物医疗有限公司(Conjupro Biotherapeutics)向美国专利商标局(USPTO)提交的一项复审。该复审质疑歌礼附属公司歌礼制药(中国)有限公司一项已获授权的GLP-1美国专利(美国专利号:US12234236B1)权利要求1-9、12-17及21-25的有效性。目前,该复审仍在USPTO审查中。

近年来,国内外诸多制药巨头已经加入GLP-1赛道新一轮的竞逐。此前,恒瑞医药、信达生物等陆续公开其GLP-1靶点研究药物的临床进展,如今石药、歌礼又因专利“短兵相接”,这场减重创新药的博弈,会如何搅动细分赛道格局?
GLP-1专利之争升级
根据公告,歌礼制药(Ascletis Pharma)的GLP-1 小分子专利,被发起无效挑战。无效请求人为Conjupro Biotherapeutics(康久普乐生物医疗有限公司),而Conjupro正是石药在美国的全资子公司。

公告披露,石药尚在专利申请中的化合物10(Compound10,申请号:PCT/CN2024/140920;申请人:石药集团百克(山东)生物制药股份有限公司)与歌礼已获USPTO授权的该专利所涵盖的化合物1(Compound1)分子结构完全一致。
6月26日,石药集团百克(山东)生物制药公司于公开其GLP-1小分子专利(WO2025131043A1),该专利申请时间为2024年12月20日。

但歌礼方面表示,其向USPTO提交专利申请的日期领先石药申请的日期长达3个多月,截至本公告日期,石药的专利申请仍在审查中。
歌礼制药还在公告中声明,该专利系利用歌礼专有技术开发而成,目前正应用于公司候选药物ASC30的研发。歌礼制药包括化合物1和ASC30在内的化合物受多项专利保护。此外,USPTO已于2025年2月25日将该专利权授予歌礼制药附属公司歌礼制药(中国)有限公司。
值得注意的是,根据公告,2025年3月下旬,歌礼制药管理层曾收到由石药主动提出的关于该专利涵盖的GLP-1R激动剂化合物1的全球授权许可请求,歌礼制药婉拒了该请求。
由于该复审目前仍在USPTO审查中,可能产生的潜在影响还有待评估。
2月20日,歌礼制药披露旗下减肥药ASC30的Ib期临床数据,因期中结果积极,股价单日暴涨。据歌礼制药官方消息,这款引发市场热议的小分子口服GLP-1R激动剂(ASC30)适应症为减重,系彼时全球首款既可用于每日一次口服,也能每月一次皮下注射的小分子GLP-1R激动剂。

公开资料显示,歌礼制药这项在美国的Ib期多剂量递增研究由三个队列组成,每个队列各有8名患者服用ASC30或安慰剂。每日一次服用ASC30口服片治疗28天后,MAD队列1体重相对基线平均下降4.3%,MAD队列2体重相对基线平均下降6.3%;MAD队列1经安慰剂校准后的体重相对基线平均下降4.2%,MAD队列2经安慰剂校准后的体重相对基线平均下降6.2%。
值得关注的是,小分子口服GLP-1R激动剂研发被认为是GLP-1药物领域的重大突破。尽管目前尚无非肽类小分子GLP-1R激动剂获批上市,但已有多个产品进入后期临床试验阶段。其中,礼来与中外制药合作开发的奥格列龙(Orforglipron)被认为是进度最快的小分子口服GLP-1R激动剂,目前已处于Ⅲ期临床阶段。
业内观点分析指出,GLP-1类药物一直是近年来资本市场最青睐的领域,此番歌礼和石药在重磅领域的专利之争孰能胜出,拭目以待。
国产减肥药创新突破
随着诺和诺德的司美格鲁肽和礼来的替尔泊肽在世界舞台大放异彩,当前我国GLP-1类减肥药市场也已实现从仿制到创新的关键跃迁,国内药企通过“fast-follow+改良创新”双轨布局加速抢占市场份额。
目前,信达生物的玛仕度肽已经率先获批上市。此外,还有十余款国产GLP-1新药进入临床后期,其中双/多靶点药物占比近半数,头部企业通过构建代谢疾病全管线形成差异化竞争优势。
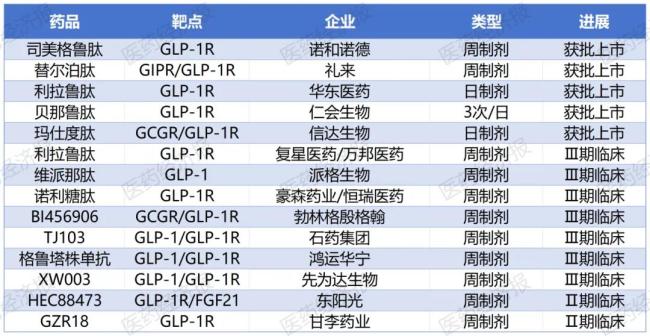
国内部分GLP-1研发进度
具体来看,信达生物日前获NMPA批准上市的玛仕度肽注射液(商品名:信尔美)是全球首个且唯一上市的GCG/GLP-1双受体激动减重降糖药物。此外,玛仕度肽的糖尿病适应症也即将申报,信达还计划拓展适应症至MASH和中重度肥胖(9mg剂量)领域。
公开资料显示,这款由信达生物与礼来联合开发的玛仕度肽(IBI362)基于天然OXM结构设计,同时激活GLP-1R和GCGR双靶点,实现协同代谢调控。
本次获批主要基于一项在超重或肥胖受试者中开展的III期注册临床研究(GLORY-1)的结果。该项研究结果显示,在第32周和48周时体重相对基线的百分比变化以及体重较基线的降幅≥5%、≥10%和≥15%的受试者比例上,信尔美®4mg和6mg均优于安慰剂组。该研究结果已在美国糖尿病学会年会(ADA)亮相,并于2025年发表于《新英格兰医学杂志》。
作为全球研发进度领先的双靶代谢药物,玛仕度肽兼具减重(临床试验显示显著疗效)、降糖及多器官代谢改善潜力,预计2025年在中国获批双适应症。
此番发起专利挑战的石药在减重药物领域也有长足布局,其在司美格鲁肽类似药领域布局双管线,分别为HD1916注射液和SYH90174长效注射液。其中,HD1916于2023年8月获批糖尿病Ⅲ期临床,2024年3月新增减重适应症试验,临床前研究显示其与原研药生物活性相当。SYH90174作为国内首个获批临床的月制剂(2024年12月),采用凝胶贮库长效技术实现每月给药一次,临床前数据证实其减重效果与日制剂相当且安全性良好。两款产品分别通过工艺创新和给药周期突破,构建了差异化的GLP-1类药物研发策略。
此外,恒瑞医药也在GLP-1靶点领域布局多管线创新药,其中双靶点激动剂HRS9531(Ⅲ期临床)治疗36周可实现22.8%减重;口服小分子HRS-7535(Ⅲ期临床)突破给药方式限制;三靶点激动剂(GLP-1/GIP/GCGR)已获批临床。2024年5月,恒瑞以HRS-9531等三款GLP-1药物与美国Kailera达成60亿美元授权协议,并获其19.9%股权,创国内药企BD出海新模式。
本土GLP-1靶向减肥药创新取得突破,标志着国产代谢疾病药物进入创新爆发期。面对代谢疾病市场的巨大潜力,尤其是减肥市场这块巨大“蛋糕”,本土药企正大幅加注。